uitsluitend voor onderzoeksdoeleinden
Crizotinib hydrochloride c-Met remmer
Cat.Nr.S5190
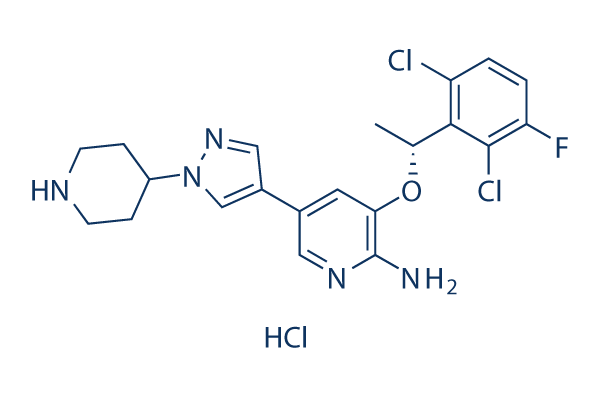
Chemische structuur
Moleculair gewicht: 486.8
Kwaliteitscontrole
| Gerelateerde doelwitten | EGFR VEGFR PDGFR FGFR Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Overige c-Met Inhibitoren | Tepotinib Dihexa SGX-523 PHA-665752 Foretinib SU11274 BMS-777607 JNJ-38877605 Tivantinib PF-04217903 |
Chemische informatie, Opslag en Stabiliteit
| Moleculair gewicht | 486.8 | Formule | C21H23Cl3FN5O |
Opslag (Vanaf de ontvangstdatum) | 3 years -20°C powder |
|---|---|---|---|---|---|
| CAS-nr. | 1415560-69-8 | -- | Opslag van stamoplossingen |
|
|
| Synoniemen | Xalkori, PF-02341066 hydrochloride | Smiles | Cl.CC(OC1=C(N)N=CC(=C1)C2=C[N](N=C2)C3CCNCC3)C4=C(Cl)C=CC(=C4Cl)F | ||
Oplosbaarheid
|
In vitro |
DMSO
: 97 mg/mL
(199.26 mM)
Water : 97 mg/mL Ethanol : 97 mg/mL |
Molariteitscalculator
|
In vivo |
|||||
In vivo Formuleringscalculator (Heldere oplossing)
Stap 1: Voer de onderstaande informatie in (Aanbevolen: Een extra dier voor het geval van verlies tijdens het experiment)
Stap 2: Voer de in vivo formulering in (Dit is alleen de calculator, geen formulering. Neem eerst contact met ons op als er geen in vivo formulering is in het gedeelte Oplosbaarheid.)
Berekeningsresultaten:
Werkconcentratie: mg/ml;
Methode voor het bereiden van DMSO-mastervloeistof: mg geneesmiddel vooraf opgelost in μL DMSO ( Concentratie mastervloeistof mg/mL, Neem eerst contact met ons op als de concentratie de DMSO-oplosbaarheid van de partij geneesmiddel overschrijdt. )
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toeμL PEG300, mengen en helder maken, voeg vervolgens toeμL Tween 80, mengen en helder maken, voeg vervolgens toe μL ddH2O, mengen en helder maken.
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toe μL Maïsolie, mengen en helder maken.
Opmerking: 1. Zorg ervoor dat de vloeistof helder is voordat u het volgende oplosmiddel toevoegt.
2. Zorg ervoor dat u het/de oplosmiddel(en) in de juiste volgorde toevoegt. U moet ervoor zorgen dat de verkregen oplossing, bij de vorige toevoeging, een heldere oplossing is voordat u verdergaat met het toevoegen van het volgende oplosmiddel. Fysische methoden zoals vortexen, echografie of een warmwaterbad kunnen worden gebruikt om het oplossen te bevorderen.
Werkingsmechanisme
| Targets/IC50/Ki |
ROS1
(Cell-free assay) <0.025 nM(Ki)
c-Met
(Cell-based assay) 11 nM
NPM-ALK
(Cell-based assay) 24 nM
|
|---|---|
| In vitro |
PF-2341066 vertoont een vergelijkbare potentie tegen c-Met-fosforylering in mIMCD3-muis- of MDCK-hondenepitheelcellen met IC50 van respectievelijk 5 nM en 20 nM. PF-2341066 toont verbeterde of vergelijkbare activiteit tegen NIH3T3-cellen die zijn gemanipuleerd om c-Met ATP-bindingsplaatsmutanten V1092I of H1094R of de P-loopmutant M1250T tot expressie te brengen, met IC50 van respectievelijk 19 nM, 2 nM en 15 nM, vergeleken met NIH3T3-cellen die de wildtype receptor tot expressie brengen met IC50 van 13 nM. Daarentegen wordt een duidelijke verschuiving in potentie van PF-2341066 waargenomen tegen cellen die zijn gemanipuleerd om c-Met-activeringslusmutanten Y1230C en Y1235D tot expressie te brengen, met IC50 van respectievelijk 127 nM en 92 nM, vergeleken met de wildtype receptor. PF-2341066 voorkomt ook krachtig de fosforylering van c-Met in NCI-H69- en HOP92-cellen, met IC50 van respectievelijk 13 nM en 16 nM, die de endogene c-Met-varianten R988C en T1010I tot expressie brengen. PF-2341066 is >1.000-voudig selectief voor de VEGFR2- en PDGFRβ-RTK's, >250-voudig selectief voor IRK en Lck, en ∼40- tot 60-voudig selectief voor Tie2, TrkA en TrkB, allemaal vergeleken met c-Met. PF-2341066 is 20- tot 30-voudig selectief voor RON- en Axl-RTK's. Daarentegen vertoont PF-2341066 een bijna-equivalente IC50 van 24 nM tegen de nucleofosmine (NPM)-anaplastische lymfoomkinase (ALK) oncogene fusievariant van de ALK RTK die tot expressie wordt gebracht door de KARPAS299 menselijke anaplastische grootcellige lymfoom (ALCL) cellijn. PF-2341066 remt c-Met-afhankelijke neoplastische fenotypes van kankercellen en angiogene fenotypes van endotheelcellen. PF-2341066 onderdrukt de groei van menselijke GTL-16 maagcarcinoomcellen met IC50 van 9,7 nM. PF-2341066 induceert apoptose in GTL-16-cellen met IC50 van 8,4 nM. PF-2341066 remt HGF-gestimuleerde migratie en invasie van menselijke NCI-H441 longcarcinoomcellen met IC50 van respectievelijk 11 nM en 6,1 nM. PF-2341066 remt MDCK-celverspreiding met IC50 van 16 nM. PF-2341066 voorkomt HGF-gestimuleerde c-Met-fosforylering, celoverleving en Matrigel-invasie met IC50 van respectievelijk 11 nM, 14 nM en 35 nM. Bovendien voorkomt PF-2341066 serum-gestimuleerde HMVEC-vertakkende tubulogenese (vorming van vasculaire buisjes) in fibrinegels. |
| Kinase Assay |
Cellulaire kinasefosforylering ELISA-assays
|
|
Cellen worden uitgezaaid in 96-well platen in media aangevuld met 10% foetaal runderserum (FBS) en na 24 uur overgebracht naar serumvrije media [met 0,04% runderserumalbumine (BSA)]. In experimenten die ligandafhankelijke RTK-fosforylering onderzoeken, worden overeenkomstige groeifactoren tot 20 minuten toegevoegd. Na incubatie van cellen met PF-2341066 gedurende 1 uur en/of geschikte liganden gedurende de aangegeven tijden, worden cellen eenmaal gewassen met HBSS aangevuld met 1 mM Na3VO4, en worden eiwitlysaten gegenereerd uit cellen. Vervolgens wordt de fosforylering van geselecteerde proteïnekinasen beoordeeld met een sandwich ELISA-methode met behulp van specifieke vangantistoffen die worden gebruikt om 96-well platen te coaten en een detectieantistof die specifiek is voor gefosforyleerde tyrosineresiduen. Antilichaam-gecoate platen worden (a) 's nachts bij 4°C geïncubeerd in aanwezigheid van eiwitlysaten; (b) zeven keer gewassen in 1% Tween 20 in PBS; (c) geïncubeerd in een mierikswortelperoxidase-geconjugeerd anti-totaal-fosfotyrosine (PY-20) antilichaam (1:500) gedurende 30 minuten; (d) opnieuw zeven keer gewassen; (e) geïncubeerd in 3,3′,5,5′-tetramethylbenzidineperoxidasesubstraat om een colorimetrische reactie te initiëren die wordt gestopt door toevoeging van 0,09 N H2SO4; en (f) gemeten op absorptie bij 450 nm met behulp van een spectrofotometer.
|
|
| In vivo |
In het GTL-16-model toont PF-2341066 het vermogen om een duidelijke regressie van grote gevestigde tumoren (>600 mm3) te veroorzaken in zowel de behandelingscohorten van 50 mg/kg/dag als 75 mg/kg/dag, met een afname van 60% in het gemiddelde tumorvolume over het toedieningsschema van 43 dagen. In een andere studie toont PF-2341066 het vermogen om de tumorgroei van GTL-16 volledig te remmen gedurende >3 maanden, waarbij slechts 1 van de 12 muizen een significante toename van de tumorgroei vertoonde over het behandelingsschema van 3 maanden bij 50 mg/kg/dag. In het NCI-H441 NSCLC-model wordt een afname van 43% in het gemiddelde tumorvolume waargenomen bij 50 mg/kg/dag tijdens de 38-daagse PF-2341066-toedieningscyclus. In het Caki-1 RCC-model wordt een afname van 53% in het gemiddelde tumorvolume waargenomen, geassocieerd met een afname van het volume van elke tumor met ten minste 30% bij 50 mg/kg/dag tijdens de 33-daagse PF-2341066-toedieningscyclus. PF-2341066 toont ook een bijna-volledige preventie van de groei van gevestigde tumoren bij 50 mg/kg/dag in de U87MG glioblastoom- of PC-3 prostaatcarcinoom-xenograftmodellen, met respectievelijk 97% of 84% remming op de laatste studiedag. Daarentegen remt PF-2341066 p.o. gegeven bij 50 mg/kg/dag de tumorgroei niet significant in het MDA-MB-231 borstcarcinoommodel of het DLD-1 coloncarcinoommodel. Een significante dosisafhankelijke reductie van CD31-positieve endotheelcellen wordt waargenomen bij 12,5 mg/kg/dag, 25 mg/kg/dag en 50 mg/kg/dag in GTL-16-tumoren, wat aangeeft dat remming van MVD een dosisafhankelijke correlatie vertoont met antitumorale werkzaamheid. PF-2341066 vertoont een significante dosisafhankelijke reductie van menselijke VEGFA- en IL-8-plasmaspiegels in zowel de GTL-16- als U87MG-modellen. Een duidelijke remming van gefosforyleerde c-Met-, Akt-, Erk-, PLCλ1- en STAT5-niveaus wordt waargenomen in GTL-16-tumoren na orale toediening van PF-2341066.
|
Referenties |
|
Informatie klinische proef
(gegevens van https://clinicaltrials.gov, bijgewerkt op 2024-05-22)
| NCT-nummer | Rekrutering | Aandoeningen | Sponsor/Medewerkers | Startdatum | Fasen |
|---|---|---|---|---|---|
| NCT06062810 | Not yet recruiting | Non-Small Cell Lung Cancer |
Han Xu M.D. Ph.D. FAPCR Sponsor-Investigator IRB Chair|Medicine Invention Design Inc |
March 28 2024 | Phase 2|Phase 3 |
| NCT04148066 | Completed | Carcinoma Non-Small-Cell Lung |
The Netherlands Cancer Institute|Roche Pharma AG |
July 17 2019 | Not Applicable |
| NCT03947385 | Recruiting | Metastatic Uveal Melanoma|Cutaneous Melanoma|Colorectal Cancer|Other Solid Tumors |
IDEAYA Biosciences |
June 28 2019 | Phase 1|Phase 2 |
| NCT03672643 | Terminated | ALK or ROS1-positive NSCLC |
Pfizer |
January 28 2019 | Phase 4 |
| NCT03439215 | Unknown status | Carcinoma Non-Small-Cell Lung |
Fondazione Ricerca Traslazionale|Clinical research technology Srl |
June 13 2017 | Phase 2 |
Technische ondersteuning
Tel: +1-832-582-8158 Ext:3
Als u nog andere vragen heeft, kunt u een bericht achterlaten.
