réservé à la recherche
NVP-BVU972 c-Met inhibiteur
N° Cat.S2761
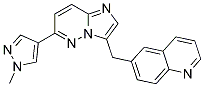
Structure chimique
Poids moléculaire: 340.38
Contrôle qualité
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- NMR
- HPLC
- SDS
- Fiche technique
| Cibles apparentées | EGFR VEGFR PDGFR FGFR Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Autre c-Met Inhibiteurs | Tepotinib Dihexa SGX-523 PHA-665752 Foretinib SU11274 BMS-777607 JNJ-38877605 Tivantinib PF-04217903 |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 340.38 | Formule | C20H16N6 |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 1185763-69-2 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | CN1C=C(C=N1)C2=NN3C(=NC=C3CC4=CC5=C(C=C4)N=CC=C5)C=C2 | ||
Solubilité
|
In vitro |
DMSO
: 68 mg/mL
(199.77 mM)
Ethanol : 68 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
Met
14 nM
|
|---|---|
| In vitro |
NVP-BVU972 inhibe puissamment la kinase MET mais montre une faible inhibition contre d'autres kinases, y compris la kinase RON, la plus étroitement liée, avec des valeurs IC50 supérieures à 1000 nM. Ce composé supprime également la phosphorylation constitutive de MET dans les cellules GTL-16 ou la phosphorylation de MET stimulée par HGF dans les cellules A549 avec des valeurs IC50 de 7,3 nM et 22 nM, respectivement. Il empêche puissamment la croissance des lignées cellulaires amplifiées par le gène MET GTL-16, MKN-45 et EBC-1 avec des valeurs IC50 de 66 nM, 82 nM et 32 nM, respectivement. Conformément à leur fréquence élevée dans ce criblage de composés, les mutations Y1230 et D1228 entraînent des décalages dramatiques des valeurs IC50 mesurées pour celui-ci dans la lignée cellulaire BaF3. La résistance déclenchée par V1155L est plus limitée à ce produit chimique. Une réduction dose-dépendante de la phosphorylation de TPR-MET lors de son application aux cellules BaF3 exprimant le TPR-MET de type sauvage. Les mutations Y1230H et D1228A ont toutes deux abrogé l'effet de ce composé mais pas celui d'AMG 458. Cependant, F1200I et L1195V interfèrent avec sa puissance pour empêcher la phosphorylation de TPR-MET.
|
| Kinase Assay |
Essai biochimique TR-FRET avec MET de type sauvage et mutants
|
|
L'activité enzymatique est mesurée par un essai de transfert d'énergie par résonance de fluorescence résolue dans le temps (TR-FRET), détectant la phosphorylation de la tyrosine avec un anticorps anti-phospho-tyrosine marqué à l'Eu (donneur de fluorescence) et de l'Allophycocyanine conjuguée à la Streptavidine (accepteur de fluorescence) qui se lie à une biotine sur le peptide substrat. Pour chaque variant, les concentrations Km d'ATP sont déterminées en l'absence de ce composé, et la concentration d'ATP dans la réaction de la kinase est fixée à Km (4 μM pour MET wt, 1 μM pour MET Y1230H et MET F1200I). Il est dissous et dilué dans du DMSO et testé en quadruplicata. Les réactions de la kinase sont effectuées dans 50 mM Tris-HCl pH 7,5, 8 mM MgCl2, 4 mM MnCl2, 0,05 % Tween 20, 0,05 % d'albumine sérique bovine, 0,1 mM EDTA, 1 mM DTT, 0,1 mM Na3VO4, dans des plaques blanches de 1536 puits à température ambiante. Ce produit chimique et l'enzyme sont incubés dans un volume de 2 μL pendant 20 min, suivi de l'ajout de 1 μL d'ATP et de 1 μL de peptide substrat biotinylé (PTK1) à des concentrations finales de Km et 1 μM, respectivement. Les concentrations d'enzyme dans les réactions sont de 5 nM pour MET wt, et de 4 nM pour les variants F1200I et Y1230H. Après 90 min, les réactions sont arrêtées par l'ajout de 1 μL de solution d'arrêt/détection pour atteindre des concentrations finales de 10 mM EDTA, 3,5 nM d'anticorps anti-phospho-tyrosine PY20 marqué à l'Eu, et 10 nM de Streptavidine Allophycocyanine. Le transfert d'énergie par résonance de fluorescence résolue dans le temps est mesuré dans un lecteur de plaques Envision (excitation 320 nm, émission 615 nm et 665 nm).
|
Références |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
