réservé à la recherche
Meldonium Hydroxylase inhibiteur
N° Cat.S4130
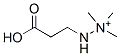
Structure chimique
Poids moléculaire: 147.19
Contrôle qualité
| Cibles apparentées | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase PPAR Vitamin Carbohydrate Metabolism Mitochondrial Metabolism |
|---|---|
| Autre Hydroxylase Inhibiteurs | Ro 61-8048 4-Chloro-DL-phenylalanine Nepicastat (SYN-117) HCl 2-Thiouracil (R)-Nepicastat HCl H-Tyr(3-I)-OH |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 147.19 | Formule | C6H14N2O2 |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 76144-81-5 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | MET-88, Quaterin | Smiles | C[N+](C)(C)NCCC(=O)[O-].O.O | ||
Solubilité
|
In vitro |
Water : 29 mg/mL Ethanol : 29 mg/mL
DMSO
: Insoluble
|
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
GBB hydroxylase
|
|---|---|
| In vitro |
Meldonium (40 μM) inhibe la réaction de la γ-butyrobétaïne hydroxylase avec la γ-butyrobétaïne avec des Km et Vmax de 36,8 μM et 0,08 nmol/min/mg de protéine, respectivement. |
| In vivo |
L'administration orale de Meldonium à des rats pendant 10 jours (150 mg/kg) provoque une réduction de la carnitine libre myocardique et du contenu en acylcarnitine à longue chaîne de 63,7 et 74,3 %, respectivement. Ce traitement composé (100 mg/kg, par voie orale) après administration d'isoprotérénol entraîne une réduction de la concentration de carnitine libre de 48,7 % par rapport aux rats recevant de l'isoprotérénol. Une administration préalable de cette substance chimique protège efficacement le myocarde des variations induites par l'isoprotérénol dans le contenu d'ATP et la charge énergétique myocardique, ainsi que la prévention d'une augmentation de l'activité de la créatine phosphokinase et de la lactate déshydrogénase. Ce composé (200 mg/kg) en traitement à long terme augmente significativement le taux d'absorption du glucose stimulé par l'insuline de 35 % et l'expression du transporteur de glucose 4 (augmentation de 1,7 fois), de l'hexokinase II (augmentation de 2,1 fois), des protéines réceptrices de l'insuline (augmentation de 2,5 fois) et des carnitine palmitoyltransférases IA (augmentation de 2,2 fois) dans les cœurs de souris. Ce traitement chimique à long terme diminue statistiquement significativement la glycémie à jeun de 6 à 5 mM. Il réduit les altérations induites par l'azidothymidine dans le tissu cérébral de la souris. Ce composé (50 mg/kg) normalise l'augmentation de la caspase-3, de la protéine de susceptibilité à l'apoptose cellulaire (CAS) et de l'expression de l'iNOS. Il normalise également les changements dans l'expression de la cytochrome c oxydase (COX), réduit l'expression de la protéine fibrillaire acide gliale (GFAP) et l'infiltration cellulaire. Cette substance chimique présente des effets protecteurs dans un modèle expérimental de diabète de type 2 chez les rats Goto-Kakizaki. Son traitement (200 mg/kg) diminue la glycémie à jeun et postprandiale. Ce composé inhibe fortement l'accumulation de fructosamine et la perte de sensibilité à la douleur (de 75 %) et améliore également la réactivité contractile accrue des anneaux aortiques de rats Goto-Kakizaki à la phényléphrine. De plus, dans les cœurs traités avec cette substance chimique, la zone de nécrose après occlusion coronarienne est significativement diminuée de 30 %. |
Références |
|
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
