réservé à la recherche
Candesartan Cilexetil Angiotensin Receptor antagoniste
N° Cat.S2037
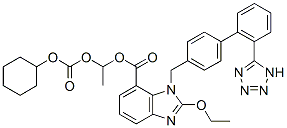
Structure chimique
Poids moléculaire: 610.66
Contrôle qualité
| Cibles apparentées | CXCR Hedgehog/Smoothened PKA Adrenergic Receptor AChR 5-HT Receptor Histamine Receptor Dopamine Receptor Ras KRas |
|---|---|
| Autre Angiotensin Receptor Inhibiteurs | PD123319 ML221 A-779 Fimasartan Olodanrigan (EMA401) Buloxibutid AVE 0991 |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 610.66 | Formule | C33H34N6O6 |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 145040-37-5 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | TCV-116 | Smiles | CCOC1=NC2=CC=CC(=C2N1CC3=CC=C(C=C3)C4=CC=CC=C4C5=NNN=N5)C(=O)OC(C)OC(=O)OC6CCCCC6 | ||
Solubilité
|
In vitro |
DMSO
: 122 mg/mL
(199.78 mM)
Ethanol : 4 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
Ang II receptor
0.26 nM
|
|---|---|
| In vitro |
Le Candesartan bloque les effets de l'angiotensine II au niveau du récepteur de l'angiotensine II de type 1 (AT1). Le Candesartan cilexetil est une prodrogue qui est activée en candesartan par hydrolyse d'ester lors de l'absorption gastro-intestinale.
|
| In vivo |
Le Candesartan améliore les marqueurs fonctionnels de manière dose-dépendante et régule également à la hausse Ang (1-7), ACE2 et mas1 dans le myocarde des rats atteints de CMD. Le Candesartan réduit divers marqueurs de stress du RE et d'apoptose, ainsi que le nombre de cellules apoptotiques chez les rats traités au Candesartan. Le Candesartan cilexetil montre une action bloquante de l'angiotensine-II de manière dose-dépendante chez les rats atteints de cardiomyopathie dilatée. Le Candesartan cilexetil réduit la pression télédiastolique ventriculaire gauche et le rapport poids du cœur/poids corporel, la zone de fibrose myocardique et les expressions du facteur de croissance transformant-bêta1 et de l'ARNm du collagène-III. Le Candesartan cilexetil (1 mg/kg, p.o.) et l'énalapril (10 mg/kg, p.o.) réduisent la pression artérielle dans la même mesure 5 heures après l'administration le 1er et le 7ème jour. Le Candesartan cilexetil augmente significativement le débit sanguin rénal sans aucune modification de l'indice cardiaque. Le TCV-116 et l'énalapril ont également tendance à augmenter le débit sanguin splanchnique après la 1ère dose mais pas après la 7ème dose. Le Candesartan cilexetil est absorbé par l'intestin grêle et hydrolysé complètement en métabolite pharmacologiquement actif M-I pendant le processus d'absorption.
|
Références |
|
Informations sur lessai clinique
(données de https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Sponsor/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT02609711 | Unknown status | Healthy Male Subjects |
Ahn-Gook Pharmaceuticals Co.Ltd |
November 2015 | Phase 1 |
| NCT00984529 | Completed | Chronic Heart Failure |
AstraZeneca |
September 2009 | -- |
| NCT00844324 | Completed | Hypertension |
AstraZeneca |
March 2009 | Phase 1 |
| NCT00244595 | Completed | Hypertension |
AstraZeneca |
September 2003 | Phase 3 |
| NCT00244634 | Completed | Pediatric Hypertension |
AstraZeneca |
September 2003 | Phase 3 |
| NCT00242346 | Completed | Proteinuria |
AstraZeneca |
April 2003 | Phase 3 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
