Données techniques
| Formule | C22H27FN4O2.C4H6O5 |
||||||
| Poids moléculaire | 532.56 | N° CAS | 341031-54-7 | ||||
| Solubilité (25°C)* | In vitro | DMSO | 100 mg/mL (187.77 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In Vivo (Ajoutez les solvants au produit individuellement et dans lordre.) |
|
||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||
Préparation des solutions mères
Activité biologique
| Description | Le Sunitinib malate est un inhibiteur de RTK multi-cibles visant VEGFR2 (Flk-1) et PDGFRβ avec une IC50 de 80 nM et 2 nM dans des tests sans cellules, et inhibe également c-Kit. Le Sunitinib Malate inhibe efficacement l'autophosphorylation d'Ire1α. Le Sunitinib Malate augmente à la fois le récepteur de mort et l'apoptose dépendante des mitochondries. | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Cibles |
|
||||||||||
| In vitro | Le Sunitinib inhibe également puissamment Kit et FLT-3. Le Sunitinib est un puissant inhibiteur compétitif de l'ATP de VEGFR2 (Flk1) et PDGFRβ avec des Ki de 9 nM et 8 nM, respectivement, affichant une sélectivité >10 fois supérieure pour VEGFR2 et PDGFR que pour FGFR-1, EGFR, Cdk2, Met, IGFR-1, Abl et src. Dans les cellules NIH-3T3 privées de sérum exprimant VEGFR2 ou PDGFRβ, le Sunitinib inhibe la phosphorylation de VEGFR2 dépendante du VEGF et la phosphorylation de PDGFRβ dépendante du PDGF avec une IC50 de 10 nM et 10 nM, respectivement. Le Sunitinib inhibe la prolifération induite par le VEGF des HUVEC privées de sérum avec une IC50 de 40 nM, et inhibe la prolifération induite par le PDGF des cellules NIH-3T3 surexprimant PDGFRβ ou PDGFRα avec une IC50 de 39 nM et 69 nM, respectivement. Le Sunitinib inhibe la phosphorylation des FLT3 de type sauvage, FLT3-ITD et FLT3-Asp835 avec des IC50 de 250 nM, 50 nM et 30 nM, respectivement. Le Sunitinib inhibe la prolifération des cellules MV4;11 et OC1-AML5 avec des IC50 de 8 nM et 14 nM, respectivement, et induit l'apoptose de manière dose-dépendante. |
||||||||||
| In Vivo | Conformément à l'inhibition substantielle et sélective de la phosphorylation et de la signalisation de VEGFR2 ou PDGFR in vivo, le Sunitinib (20-80 mg/kg/jour) présente une activité antitumorale large et puissante dose-dépendante contre une variété de modèles de xénogreffes tumorales, y compris HT-29, A431, Colo205, H-460, SF763T, C6, A375 ou MDA-MB-435. L'administration de Sunitinib à 80 mg/kg/jour pendant 21 jours entraîne une régression tumorale complète chez six des huit souris, sans repousse tumorale pendant une période d'observation de 110 jours après la fin du traitement. Une deuxième série de traitement avec le Sunitinib reste efficace contre les tumeurs qui n'ont pas complètement régressé pendant la première série de traitement. Le traitement au Sunitinib entraîne une diminution significative de la MVD tumorale, avec une réduction d'environ 40 % dans les tumeurs de gliome SF763T. Le traitement au SU11248 entraîne une inhibition complète de la croissance tumorale supplémentaire des xénogreffes PC-3M exprimant la luciférase, malgré l'absence de réduction de la taille de la tumeur. Le traitement au Sunitinib (20 mg/kg/jour) supprime de manière spectaculaire la croissance des xénogreffes sous-cutanées MV4;11 (FLT3-ITD) et prolonge la survie dans le modèle de greffe de moelle osseuse FLT3-ITD. |
Protocole (de référence)
| Test kinase : |
|
|---|---|
| Test cellulaire : |
|
| Étude animale : |
|
Références
|
Validation du produit par le client
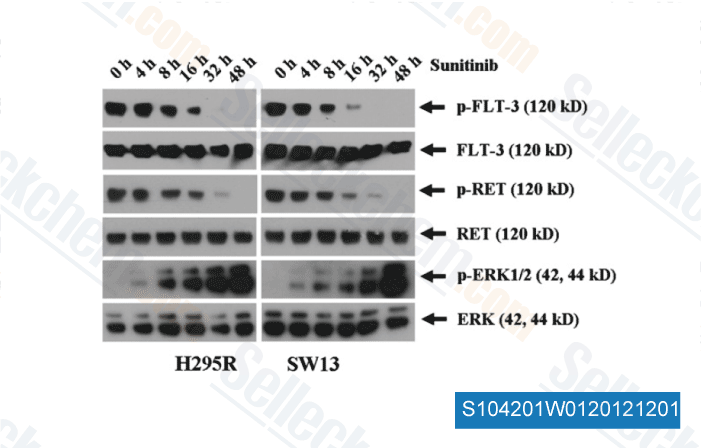
-
Données de [ Surgery , 2012 , 152, 1045-50 ]
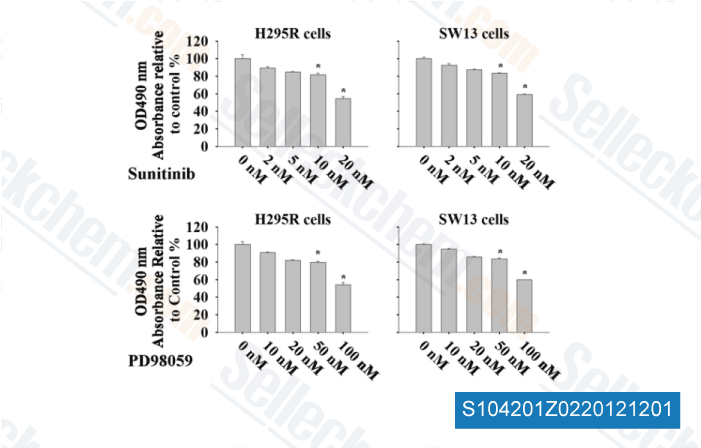
-
Données de [ Surgery , 2012 , 152, 1045-50 ]
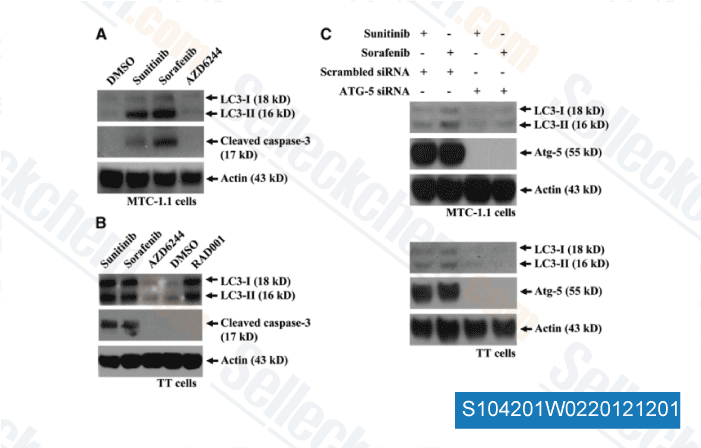
-
Données de [ Surgery , 2012 , 152, 1142-9 ]
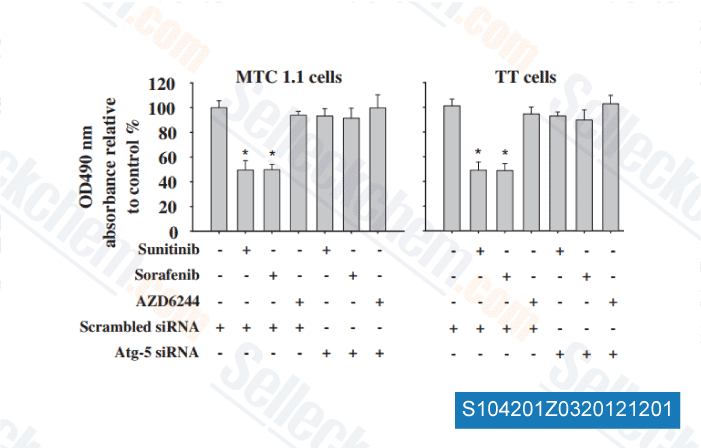
-
Données de [ Surgery , 2012 , 152, 1142-9 ]
De Selleck Sunitinib (SU11248) Malate A été cité par 176 Publications
| Prolonging lung cancer response to EGFR inhibition by targeting the selective advantage of resistant cells [ Nat Commun, 2025, 16(1):7853] | PubMed: 40846697 |
| Electroacupuncture Prevents Against AD-Like Phenotypes in APP/PS1 Mice: Investigation of the Mechanisms From Cerebral Microangiopathy [ CNS Neurosci Ther, 2025, 31(12):e70696] | PubMed: 41367129 |
| Biofabrication of pheochromocytoma and paraganglioma tumor organoids and assessment of response to systemic therapy [ Sci Rep, 2025, 15(1):35889] | PubMed: 41087622 |
| Overexpression of CSRP1 Suppresses Cell Viability and Enhances the Anti-Cancer Effects of Anti-PD-L1 Therapy in Renal Cell Carcinoma [ Front Biosci (Landmark Ed), 2025, 30(11):46252] | PubMed: 41351404 |
| Establishment, characterization, and biobanking of 36 pancreatic cancer organoids: prediction of metastasis in resectable pancreatic cancer [ Cell Oncol (Dordr), 2024, 10.1007/s13402-024-00939-5] | PubMed: 38619751 |
| Patient-derived rhabdomyosarcoma cells recapitulate the genetic and transcriptomic landscapes of primary tumors [ iScience, 2024, 27(10):110862] | PubMed: 39319271 |
| Canthin-6-One Inhibits Developmental and Tumour-Associated Angiogenesis in Zebrafish [ Pharmaceuticals (Basel), 2024, 17(1)108] | PubMed: 38256941 |
| Impact of sunitinib resistance on clear cell renal cell carcinoma therapeutic sensitivity in vitro [ Cell Cycle, 2024, 1-13.] | PubMed: 38263737 |
| Multi-omics and immunogenomics analysis revealed PFKFB3 as a targetable hallmark and mediates sunitinib resistance in papillary renal cell carcinoma: in silico study with laboratory verification [ Eur J Med Res, 2024, 29(1):236] | PubMed: 38622715 |
| Elucidation and Regulation of Tyrosine Kinase Inhibitor Resistance in Renal Cell Carcinoma Cells from the Perspective of Glutamine Metabolism [ Metabolites, 2024, 14(3)170] | PubMed: 38535330 |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
