Données techniques
| Formule | C15H14N2O |
||||||||||||||
| Poids moléculaire | 238.28 | N° CAS | 204005-46-9 | ||||||||||||
| Solubilité (25°C)* | In vitro | DMSO | 16 mg/mL (67.14 mM) | ||||||||||||
| Ethanol | 3 mg/mL (12.59 mM) | ||||||||||||||
| Water | Insoluble | ||||||||||||||
| In Vivo (Ajoutez les solvants au produit individuellement et dans lordre.) |
|
||||||||||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||||||||||
Préparation des solutions mères
Activité biologique
| Description | Le Semaxanib (SU5416, semaxinib) est un inhibiteur puissant et sélectif du VEGFR (Flk-1/KDR) avec un IC50 de 1,23 μM, 20 fois plus sélectif pour le VEGFR que le PDGFRβ, et dépourvu d'activité contre l'EGFR, l'InsR et le FGFR. Phase 3. Il peut être utilisé pour induire des modèles animaux d'hypoxie intermittente chronique. | ||
|---|---|---|---|
| Cibles |
|
||
| In vitro | Le Semaxanib (SU5416) inhibe la phosphorylation dépendante du VEGF du récepteur Flk-1 dans les cellules NIH 3T3 surexprimant Flk-1 avec un IC50 de 1,04 μM, et l'autophosphorylation dépendante du PDGF dans les cellules NIH 3T3 avec un IC50 de 20,3 μM. Il inhibe également la mitogenèse induite par le VEGF et le FGF de manière dose-dépendante avec un IC50 de 0,04 et 50 μM, respectivement. Le traitement avec ce composé n'a aucun effet sur la croissance in vitro des cellules de gliome C6, de carcinome pulmonaire Calu 6, de mélanome A375, de carcinome épidermoïde A431 et de gliome SF767T (tous les IC50 > 20 μM). | ||
| In Vivo | Le Semaxanib (SU5416) inhibe la croissance de la tumeur A375 in vivo de manière dose-dépendante. Une inhibition >85% de la croissance tumorale sous-cutanée est observée avec une administration i.p. quotidienne de ce composé dans du DMSO, sans toxicité mesurable. Il présente une activité antitumorale à large spectre, inhibant significativement la croissance sous-cutanée de 8 des 10 lignées tumorales testées (cellules A431, Calu-6, C6, LNCAP, EPH4-VEGF, 3T3HER2, 488G2M2 et SF763T) avec un taux de mortalité moyen de 2,5%. À 25 mg/kg/jour, il affiche une puissante activité anti-angiogénique, entraînant une réduction significative de la densité vasculaire totale et fonctionnelle de la microvascularisation tumorale. |
Protocole (de référence)
| Test kinase :[1] |
|
|---|---|
| Test cellulaire :[1] |
|
| Étude animale :[1] |
|
Références
|
Validation du produit par le client
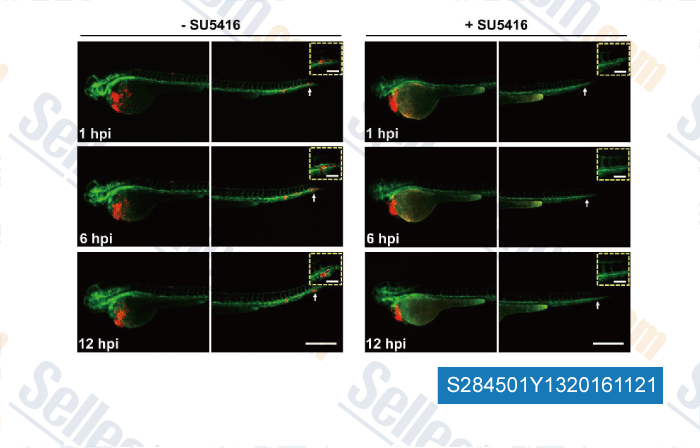
-
Données de [ , , Sci Rep, 2016, 6:19304. ]
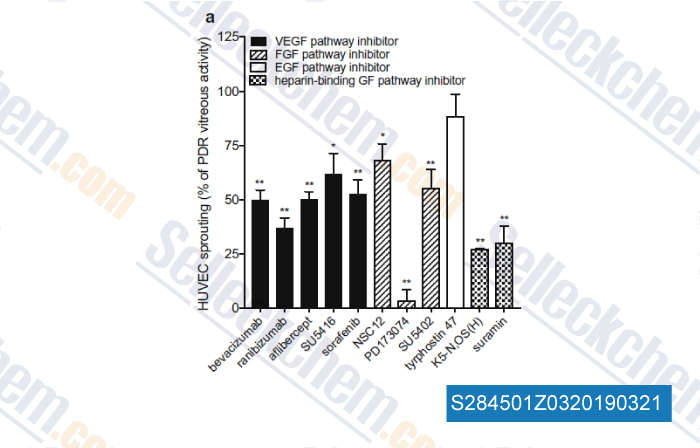
-
Données de [ , , Angiogenesis, 2017, 20(4):629-640 ]
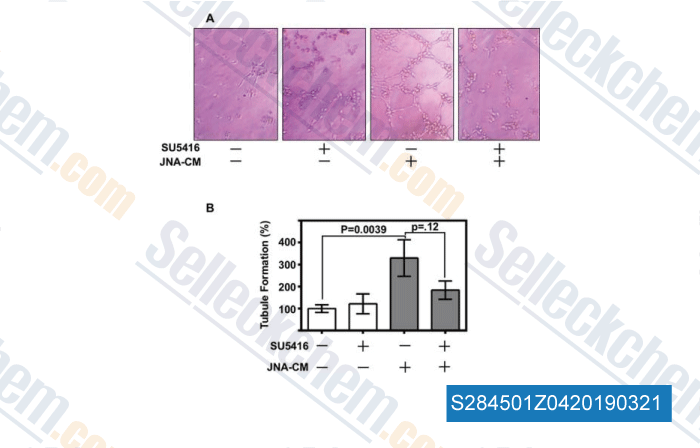
-
Données de [ , , Int Forum Allergy Rhinol, 2017, 7(10):973-979 ]
De Selleck Semaxanib (SU5416) A été cité par 21 Publications
| LONP1 facilitates pulmonary artery smooth muscle cell glycolytic reprogramming by degrading MPC1 in pulmonary hypertension [ Clin Sci (Lond), 2025, 139(10)CS20255922] | PubMed: 40332105 |
| APOE- ε4-induced Fibronectin at the blood-brain barrier is a conserved pathological mediator of disrupted astrocyte-endothelia interaction in Alzheimer's disease [ bioRxiv, 2025, 2025.01.24.634732] | PubMed: 39975303 |
| Gliovascular transcriptional perturbations in Alzheimer's disease reveal molecular mechanisms of blood brain barrier dysfunction [ Nat Commun, 2024, 15(1):4758] | PubMed: 38902234 |
| Endothelial Slc35a1 Deficiency Causes Loss of LSEC Identity and Exacerbates Neonatal Lipid Deposition in the Liver in Mice [ Cell Mol Gastroenterol Hepatol, 2024, 17(6):1039-1061] | PubMed: 38467191 |
| A novel twelve-gene signature to predict neoadjuvant chemotherapy response and prognosis in breast cancer [ Front Immunol, 2022, 13:1035667] | PubMed: 36341435 |
| VEGF Modulates Neurogenesis and Microvascular Remodeling in Epileptogenesis After Status Epilepticus in Immature Rats [ Front Neurol, 2021, 12:808568] | PubMed: 35002944 |
| PKR deficiency alleviates pulmonary hypertension via inducing inflammasome adaptor ASC inactivation [ Pulm Circ, 2021, 11(4):20458940211046156] | PubMed: 34540200 |
| Uncovering mutation-specific morphogenic phenotypes and paracrine-mediated vessel dysfunction in a biomimetic vascularized mammary duct platform [ Nat Commun, 2020, 11(1):3377] | PubMed: 32632100 |
| RhoJ integrates attractive and repulsive cues in directional migration of endothelial cells [ EMBO J, 2020, 39(12):e102930] | PubMed: 32347571 |
| Activation of inflammasomes by tyrosine kinase inhibitors of vascular endothelial growth factor receptor: Implications for VEGFR TKIs-induced immune related adverse events [ Toxicol In Vitro, 2020, 71:105063] | PubMed: 33271325 |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
