Données techniques
| Formule | C13H14ClN3O4 |
||||||
| Poids moléculaire | 311.72 | N° CAS | 501925-31-1 | ||||
| Solubilité (25°C)* | In vitro | DMSO | 62 mg/mL (198.89 mM) | ||||
| Ethanol | 1 mg/mL (3.2 mM) | ||||||
| Water | Insoluble | ||||||
| In Vivo (Ajoutez les solvants au produit individuellement et dans lordre.) |
|
||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||
Préparation des solutions mères
Activité biologique
| Description | PNU-120596 (Nsc 216666) est un modulateur allostérique positif de α7 nAChR avec une EC50 de 216 nM. | ||
|---|---|---|---|
| Cibles |
|
||
| In vitro | PNU-120596 augmente le flux de calcium évoqué par l'agoniste (Ach) médié par une variante ingénierie du récepteur α7 nAChR humain. Ce composé augmente les courants évoqués par les agonistes (choline et ACh) médiés par les récepteurs de type sauvage et démontre également une prolongation prononcée de la réponse évoquée en présence continue de l'agoniste dans les ovocytes de Xenopus. Il augmente le temps d'ouverture moyen du canal des α7 nAChR mais n'a aucun effet sur la sélectivité ionique et relativement peu, voire pas du tout, d'effet sur la conductance unitaire. Lorsqu'il est appliqué à des tranches hippocampiques aiguës, ce produit chimique augmente la fréquence des courants postsynaptiques GABAergiques évoqués par l'ACh mesurés dans les neurones pyramidaux ; cet effet est supprimé par le TTX, suggérant qu'il module la fonction des α7 nAChR situés sur la membrane somatodendritique des interneurones hippocampiques. Outre la modulation positive de l'α7 nAChR, ce composé induit un profond retardement de la cinétique de désensibilisation, augmentant le potentiel de toxicité induite par le Ca2+ par une stimulation excessive de l'α7 nAChR. Il provoque des changements dans l'accessibilité de la cystéine au niveau du feuillet bêta interne, de la zone de transition et du site de liaison de l'agoniste lors de sa liaison à l'α7 nAChR. Les sites de liaison pour ce produit chimique ne se trouvent pas dans les sites de liaison de l'agoniste et il améliore la régulation du gating évoquée par l'agoniste des récepteurs nicotiniques en déclenchant des effets conformationnels similaires mais non identiques aux conformations de gating favorisées par l'Ach. | ||
| In Vivo | L'administration systémique de PNU-120596 (1 mg/kg) à des rats améliore le déficit de gating auditif causé par l'amphétamine, un modèle proposé pour refléter une perturbation au niveau du circuit associée à la schizophrénie. Lorsqu'il est administré avant la carragénine, 30 mg/kg de ce composé atténuent significativement l'hyperalgésie mécanique et les déficits de support de poids pendant une durée allant jusqu'à 4 heures. Ce produit chimique atténue l'augmentation induite par la carragénine des niveaux de TNF-α et d'IL-6 dans l'œdème de la patte arrière ; le diclofénac n'a atténué que les niveaux d'IL-6. L'hyperalgésie mécanique établie induite par la carragénine ou la CFA est également partiellement inversée par cet agent. |
Protocole (de référence)
| Test kinase :[1] |
|
|---|---|
| Test cellulaire :[2] |
|
| Étude animale :[1] |
|
Références
|
Validation du produit par le client
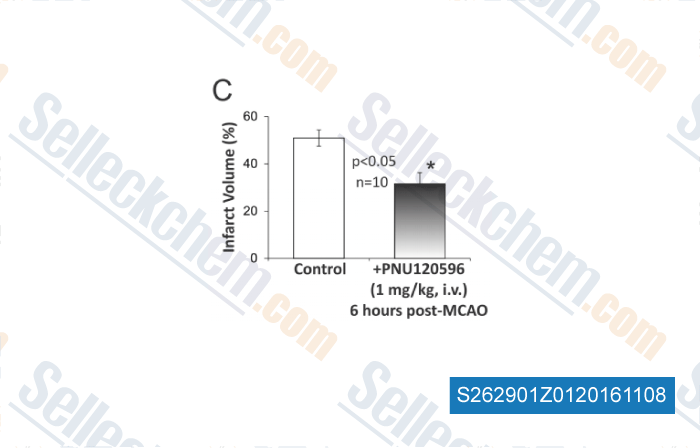
-
, , PLoS One, 2013, 8(8): e73581.
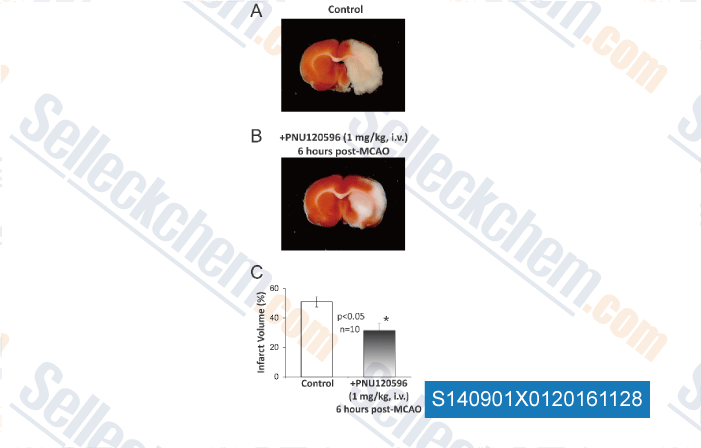
-
Données de [ , , PLoS One, 2013, 8(8):e73581. ]
De Selleck PNU-120596 A été cité par 9 Publications
| Systemic Administration of α7-Nicotinic Acetylcholine Receptor Ligands Does Not Improve Renal Injury or Behavior in Mice With Advanced Systemic Lupus Erythematosus [ Front Med (Lausanne), 2021, 8:642960] | PubMed: 33928103 |
| Inhibitory effect of sinomenine on lung cancer cells via negative regulation of α7 nicotinic acetylcholine receptor [ J Leukoc Biol, 2020, 10.1002/JLB.6MA0720-344RRR] | PubMed: 32726882 |
| Alpha 7 nicotinic receptor agonist and positive allosteric modulators improved social and molecular deficits of MK-801 model of schizophrenia in rats. [ Pharmacol Biochem Behav, 2020, 10.1016/j.pbb.2020.172916] | PubMed: 32220620 |
| Investigating the Binding Interactions of NS6740, a Silent Agonist of the Nicotinic Receptor [ Mol Pharmacol, 2019, 10.1124/mol.119.116244] | PubMed: 31175182 |
| Boosting Endogenous Resistance of Brain to Ischemia. [Sun F, et al. Mol Neurobiol, 2017, 54(3):2045-2059] | PubMed: 26910820 |
| Boosting Endogenous Resistance of Brain to Ischemia [Sun F, et al. Mol Neurobiol, 2016, 10.1007/s12035-016-9796-3] | PubMed: 26910820 |
| An Unaltered Orthosteric Site and a Network of Long-Range Allosteric Interactions for PNU-120596 in α7 Nicotinic Acetylcholine Receptors [ Chem Biol, 2015, 22(8):1063-73] | PubMed: 26211363 |
| A positive allosteric modulator of α7 nAChRs augments neuroprotective effects of endogenous nicotinic agonists in cerebral ischaemia [ Br J Pharmacol, 2013, 169(8):1862-78] | PubMed: 23713819 |
| A Type-II Positive Allosteric Modulator of α7 nAChRs Reduces Brain Injury and Improves Neurological Function after Focal Cerebral Ischemia in Rats. [Sun F, et al. PLoS One, 2013, 8(8): e73581] | PubMed: 23951360 |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
