Données techniques
| Formule | C26H31Cl2N7O3 |
||||||
| Poids moléculaire | 560.48 | N° CAS | 872511-34-7 | ||||
| Solubilité (25°C)* | In vitro | DMSO | 1 mg/mL (1.78 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In Vivo (Ajoutez les solvants au produit individuellement et dans lordre.) |
|
||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||
Préparation des solutions mères
Activité biologique
| Description | Infigratinib (BGJ398) est un inhibiteur puissant et sélectif de FGFR pour FGFR1/2/3 avec une IC50 de 0,9 nM/1,4 nM/1 nM dans les essais acellulaires, >40 fois plus sélectif pour FGFR que pour FGFR4 et VEGFR2, et une faible activité envers Abl, Fyn, Kit, Lck, Lyn et Yes. Phase 2. | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Cibles |
|
||||||||||
| In vitro | L'Infigratinib (BGJ398) prévient également VEGFR2 avec une faible puissance, avec un IC50 de 0,18 μM pour l'inhibition de cette cible. Il supprime d'autres kinases, notamment ABL, FYN, KIT, LCK, LYN et YES avec des valeurs d'IC50 de 2,3 μM, 1,9 μM, 0,75 μM, 2,5 μM, 0,3 μM et 1,1 μM, respectivement. Au niveau cellulaire, ce composé inhibe la prolifération des cellules BaF3 dépendantes de FGFR1, FGFR2-Q et FGFR3 avec des IC50 de 2,9 μM, 2,0 μM et 2 μM, respectivement. Il interfère avec l'autophosphorylation sur des résidus tyrosine spécifiques, notamment FGFR-WT, FGFR2-WT, FGFR3-K650E, FGFR3-S249C et FGFR4-WT avec des IC50 de 4,6 nM, 4,9 nM, 5 nM, 5 nM et 168 nM, respectivement. De plus, il supprime la prolifération des cellules cancéreuses avec surexpression de FGFR3 de type sauvage (WT) telles que RT112, RT4, SW780 et JMSU1 avec des IC50 de 5 nM, 30 nM, 32 nM et 15 nM, respectivement. | ||||||||||
| In Vivo | Dans ce modèle orthotopique de xénogreffe de cancer de la vessie, le BGJ398 induit une inhibition de la croissance tumorale et une stase après administration orale pendant 12 jours consécutifs aux doses de 10 et 30 mg/kg, respectivement. Fait intéressant, les animaux qui ont reçu ce composé ne présentent soit aucune perte de poids corporel (10 mg/kg), soit un gain de poids corporel de 10 % (30 mg/kg), une indication supplémentaire d'efficacité. Les rats Rowett femelles porteurs de tumeurs RT112 reçoivent une administration orale unique du sel monophosphate d'Infigratinib (BGJ398) aux doses de 4,25 et 8,51 mg/kg. Il diminue significativement les niveaux de pFRS2 et de pMAPK de manière dose-dépendante. De plus, il inhibe significativement l'Angiogenesis stimulée par le bFGF de manière dose-dépendante. Cependant, il n'altère pas la formation de vaisseaux sanguins induite par le VEGF. |
Protocole (de référence)
| Test kinase : [1] |
|
|---|---|
| Test cellulaire :[1] |
|
| Étude animale :[1] |
|
Références
|
Validation du produit par le client

-
Données de [ Hepatology , 2014 , 59(4), 1427-34 ]
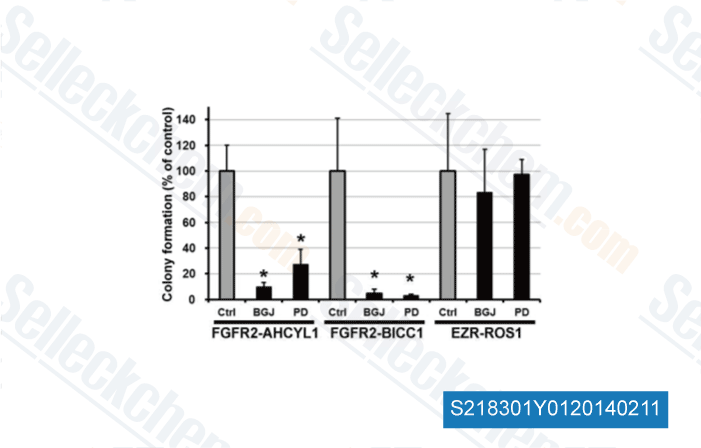
-
Données de [ Hepatology , 2014 , 59(4), 1427-34 ]

-
Données de [ J Cell Physiol , 2014 , 229(11), 1647-59 ]

-
, , Oncogene, 2017, 36(27):3831-3841
De Selleck BGJ398 (Infigratinib) A été cité par 256 Publications
| 3D-Printed Scaffolds Promote Enhanced Spinal Organoid Formation for Use in Spinal Cord Injury [ Adv Healthc Mater, 2025, e04817.] | PubMed: 40702833 |
| Selective degradation of FGFR1/2 overcomes antiestrogen resistance in ER+ breast cancer with FGFR1/2 alterations [ Cancer Lett, 2025, 619:217668] | PubMed: 40127812 |
| Abrogation of FGFR signaling blocks β-catenin-induced adrenocortical hyperplasia and aldosterone production [ JCI Insight, 2025, 10(21)e184863] | PubMed: 40956622 |
| Fibroblast growth factor receptor signaling modulates cholesterol storage in a SOAT1-dependent manner to promote mammary tumor cell invasion [ Breast Cancer Res, 2025, 27(1):132] | PubMed: 40665359 |
| Exploiting collateral sensitivity in the evolution of resistance to tyrosine kinase inhibitors in soft tissue sarcomas [ Commun Biol, 2025, 8(1):1185] | PubMed: 40781553 |
| Sonic hedgehog and fibroblast growth factor 8 regulate the evolution of amniote facial proportions [ Commun Biol, 2025, 8(1):84] | PubMed: 39827295 |
| Aspirin-triggered DHA metabolites inhibit angiogenesis [ Front Pharmacol, 2025, 16:1524980] | PubMed: 40070577 |
| Generation of an induced pluripotent stem cell line (NCHi023-A) from a 41-year-old male with nemaline myopathy carrying autosomal dominant ACTA1 c.809-10C>A mutation [ Stem Cell Res, 2025, 85:103701] | PubMed: 40147060 |
| Characterization of an induced pluripotent stem cell line NCHi025-A from a 1-year-old female with pulmonary stenosis harboring a heterozygous HAND2 variant [ Stem Cell Res, 2025, 86:103733] | PubMed: 40378586 |
| Decaying and expanding Erk gradients process memory of skeletal size during zebrafish fin regeneration [ bioRxiv, 2025, 2025.01.23.634576] | PubMed: 39896678 |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
