Données techniques
| Formule | C19H18ClN3O5S |
||||||
| Poids moléculaire | 435.88 | N° CAS | 366789-02-8 | ||||
| Solubilité (25°C)* | In vitro | DMSO | 22 mg/mL (50.47 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In Vivo (Ajoutez les solvants au produit individuellement et dans lordre.) |
|
||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||
Préparation des solutions mères
Activité biologique
| Description | Le Rivaroxaban est un inhibiteur direct du Factor Xa avec des Ki et IC50 de 0,4 nM et 0,7 nM respectivement dans les essais sans cellules. Il est sélectif pour le facteur Xa humain, pour lequel ce composé présente une sélectivité >10 000 fois supérieure à celle des autres sérine protéases biologiquement pertinentes (IC50 >20 μM). | ||||
|---|---|---|---|---|---|
| Cibles |
|
||||
| In vitro | Le Rivaroxaban est un inhibiteur oral direct du Factor Xa (FXa), en cours de développement pour la prévention et le traitement de la thrombose artérielle et veineuse avec un Ki de 0,4 nM. Ce composé inhibe également l'activité de la prothrombinase avec un IC50 de 2,1 nM. Il présente également une affinité similaire pour le FXa humain et de lapin purifié (IC50 de 0,7 nM et 0,8 nM, respectivement), mais une puissance moindre contre le FXa de rat purifié (IC50 de 3,4 nM). Le FXa humain et de lapin endogène dans le plasma est inhibé de manière similaire par cette substance chimique (IC50 de 21 nM et 21 nM, respectivement), tandis que des concentrations 14 fois plus élevées sont requises dans le plasma de rat (IC50 de 290 nM). Il présente une perméabilité élevée et un transport polarisé à travers les cellules Caco-2 en tant que substrat de la P-gp, mais ne présente aucun effet inhibiteur sur le transport de médicaments médié par la P-gp jusqu'à des concentrations de 100 μM in vitro. | ||||
| In Vivo | Le Rivaroxaban réduit la thrombose veineuse de manière dose-dépendante (ED50 0,1 mg/kg i.v.) dans un modèle de stase veineuse chez le rat. Ce composé réduit la formation de thrombus artériel dans un shunt artério-veineux (AV) chez les rats (ED50 5,0 mg/kg p.o.) et les lapins (ED50 0,6 mg/kg p.o.). La pharmacocinétique plasmatique de cette substance chimique est linéaire sur la plage de doses étudiées (1-10 mg/kg chez les rats, 0,3-3 mg/kg chez les chiens). La clairance plasmatique est faible : 0,4 L/kg/h chez les rats et 0,3 L/kg/h chez les chiens ; le volume de distribution (V(ss)) est modéré : 0,3 L/kg chez les rats et 0,4 L/kg chez les chiens. La demi-vie d'élimination après administration orale est courte chez les deux espèces (0,9-2,3 heures). |
Protocole (de référence)
| Test kinase : |
|
|---|---|
| Test cellulaire : |
|
| Étude animale : |
|
Références
|
Validation du produit par le client
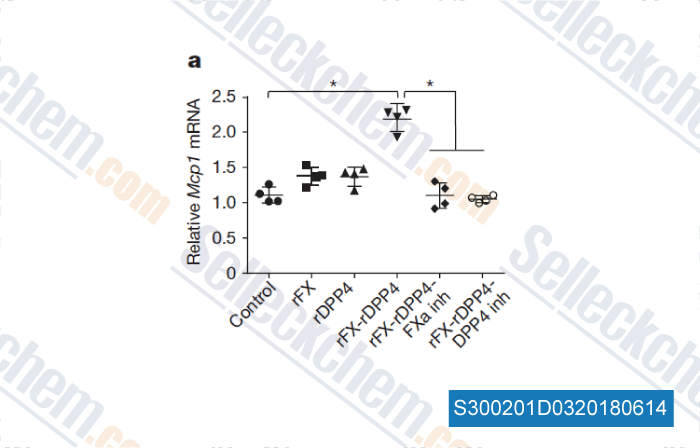
-
Données de [ , , Nature, 2018, 555(7698):673-677 ]
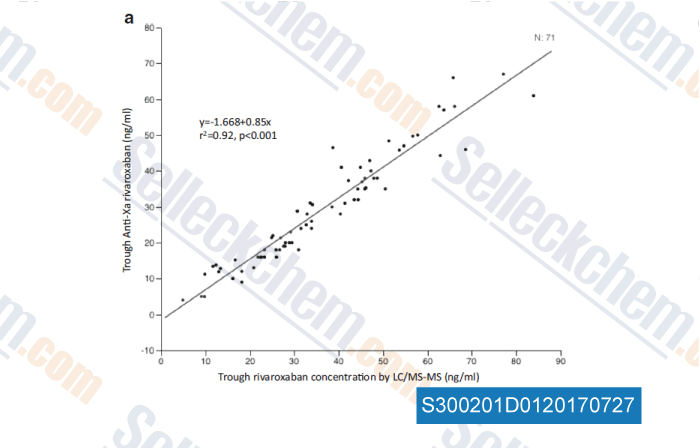
-
Données de [ , , Eur J Clin Pharmacol, 2016, 72(6):671-9 ]
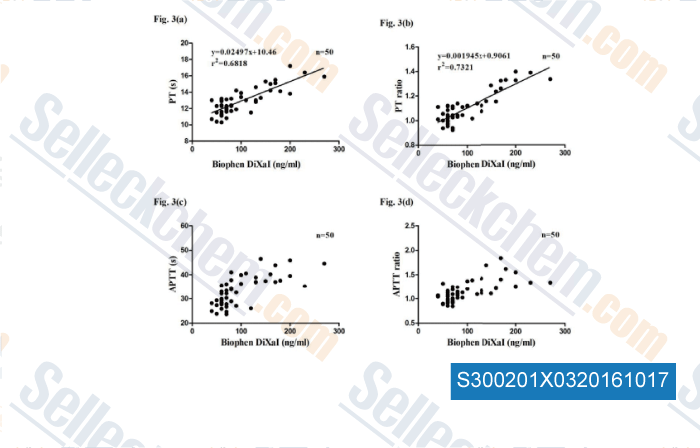
-
Données de [ , , Br J Biomed Sci, 2016, 73(3):134-139. ]
De Selleck Rivaroxaban A été cité par 30 Publications
| Real-Time Imaging of Platelet-Initiated Plasma Clot Formation and Lysis Unveils Distinct Impacts of Anticoagulants [ Thromb Haemost, 2025, 10.1055/a-2497-4213] | PubMed: 39788528 |
| Rapid Determination of Xa Inhibitor Activity in Blood Using a Microfluidic Device that Measures Platelet Deposition and Fibrin Generation Under Flow [ TH Open, 2025, 9:a25475710] | PubMed: 40182435 |
| Coagulation factor X promotes resistance to androgen-deprivation therapy in prostate cancer [ Cancer Cell, 2024, 42(10):1676-1692.e11] | PubMed: 39303726 |
| Engineering and evaluation of FXa bypassing agents that restore hemostasis following Apixaban associated bleeding [ Nat Commun, 2024, 15(1):3912] | PubMed: 38724509 |
| Detection of direct oral anticoagulants with the diluted Russel's viper venom time [ Int J Lab Hematol, 2024, 10.1111/ijlh.14300] | PubMed: 38721750 |
| Rivaroxaban attenuates neutrophil maturation in the bone marrow niche [ Basic Res Cardiol, 2023, 118(1):31] | PubMed: 37580509 |
| OKL-1111, A modified cyclodextrin as a potential universal reversal agent for anticoagulants [ Thromb Res, 2023, 227:17-24] | PubMed: 37207560 |
| pKr-2 induces neurodegeneration via upregulation of microglial TLR4 in the hippocampus of AD brain [ Brain Behav Immun Health, 2023, 28:100593] | PubMed: 36798617 |
| CM-352 EFFICACY IN A MOUSE MODEL OF ANTICOAGULANT-ASSOCIATED INTRACRANIAL HAEMORRHAGE [ Thromb Haemost, 2022, 10.1055/a-1759-9962] | PubMed: 35114692 |
| Evaluation of Xa inhibitors as potential inhibitors of the SARS-CoV-2 Mpro protease [ PLoS One, 2022, 17(1):e0262482] | PubMed: 35015795 |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
