Données techniques
| Formule | C27H29N5O |
||||||
| Poids moléculaire | 439.55 | N° CAS | 475489-16-8 | ||||
| Solubilité (25°C)* | In vitro | DMSO | 88 mg/mL (200.2 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In Vivo (Ajoutez les solvants au produit individuellement et dans lordre.) |
|
||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||
Préparation des solutions mères
Activité biologique
| Description | NVP-AEW541 est un puissant inhibiteur de IGF-1R/InsR avec une IC50 de 150 nM/140 nM dans des essais acellulaires, une puissance et une sélectivité accrues pour IGF-1R dans un essai basé sur des cellules. | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Cibles |
|
|||||||||||
| In vitro | NVP-AEW541 inhibe également InsR, Tek, Flt1 et Flt3 avec une IC50 de 140 nM, 530 nM, 600 nM et 420 nM respectivement dans un essai de kinases purifiées/domaines de kinases recombinantes. Ce composé est plus sélectif et montre une puissance 27 fois supérieure à celle d'InsR au niveau cellulaire. Il supprime la survie médiatisée par l'IGF-I, la croissance en agar mou et la prolifération des cellules MCF-7 avec une IC50 de 0,162 μM, 0,105 μM et 1,64 μM, respectivement. Ce produit chimique réduit également le niveau de phospho-IGF-1R et de phospho-PKB dans les cellules NWT-21. Il montre un effet inhibiteur de croissance sur les cellules de sarcome musculosquelettique TC-71 dans un milieu à faible sérum ainsi que dans un milieu contenant 10 % de FBS. Ce composé inhibe la progression du cycle cellulaire et induit un arrêt G1 spécifique dans les lignées cellulaires de sarcome (TC-71, SK-N-MC, SaoS-2, RD/18 et RH4). Il pourrait inhiber la croissance des cellules de neuroblastome humain avec une IC50 de 0,4-6,8 μM. Une augmentation de la fraction hypodiploïde et l'épuisement des compartiments S et G2-M pourraient être détectés dans ces lignées cellulaires. Cette inhibition de IGF-1R induite par le composé provoque une réduction de la phosphorylation d'Akt, mais pas d'Erk1 et Erk2 dans les cellules de neuroblastome. Il inhibe la croissance des cellules de gliome et perturbe la boucle autocrine initiée par la stabilisation de HIF1α. Une étude récente montre que ce produit chimique supprime la prolifération et la viabilité des cellules de cancer de la prostate PC3, DU145 et 22Rv1, sans nécessité de mort cellulaire associée. Il diminue les niveaux de phospho-Akt dans les cellules 22Rv1 et DU415 mais pas dans les cellules PC3, sans affecter les niveaux totaux d'Akt, ce qui montre que le statut PTEN pourrait déterminer l'efficacité de ce composé avec Akt essentiel. Cette radiosensibilisation induite par le composé est dépendante du statut d'activation d'Akt. Elle pourrait augmenter la phosphorylation de H2AX (une mesure des DSB) dans les cellules PC3, DU145 et 22Rv1. | |||||||||||
| In Vivo | NVP-AEW541 (50 mg/kg, p.o.) entraîne l'abrogation du récepteur basal et induit par l'IGF-I, et la phosphorylation de PKB et MAPK, avec une valeur T/C de 14 % dans le xénogreffe tumoral NWT-21. Ce composé (50 mg/kg) provoque un rétrécissement tumoral dans les xénogreffes HTLA-230 et SK-N-BE2c, sans signes de toxicité systémique. Il pourrait inhiber l'invasion tumorale à la fois dans les chambres recouvertes de Matrigel et dans les xénogreffes HTLA-230. |
Protocole (de référence)
| Test kinase :[1] |
|
|---|---|
| Test cellulaire :[1] |
|
| Étude animale :[1] |
|
Références
|
Validation du produit par le client
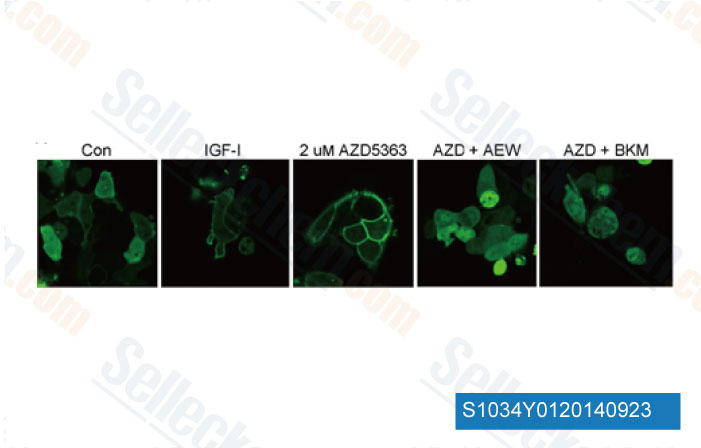
-
Données de [ Breast Cancer Res , 2013 , 15, R55 ]
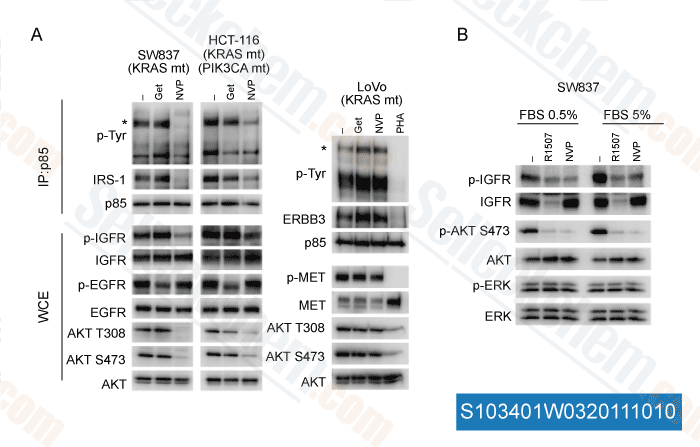
-
Données de [ J Clin Invest , 2011 , 121, 4311-21 ]
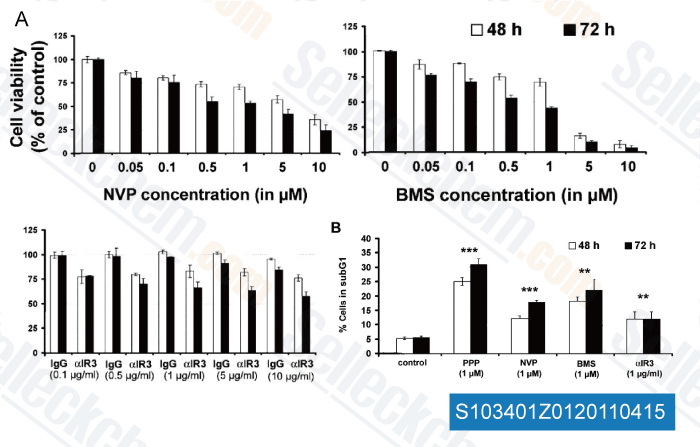
-
Données de [ Clin Cancer Res , 2011 , 17, 2237-2249 ]
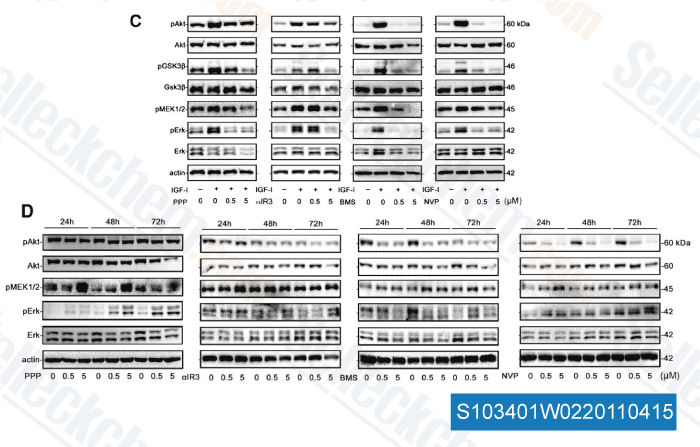
-
Données de [ Clin Cancer Res , 2011 , 17, 2237-2249 ]
De Selleck NVP-AEW541 A été cité par 67 Publications
| Translocation of IGF-1R in endoplasmic reticulum enhances SERCA2 activity to trigger Ca2+ER perturbation in hepatocellular carcinoma [ Acta Pharm Sin B, 2023, 13(9):3744-3755] | PubMed: 37719369 |
| Anatomic position determines oncogenic specificity in melanoma [ Nature, 2022, 604(7905):354-361] | PubMed: 35355015 |
| Integrative analysis of drug response and clinical outcome in acute myeloid leukemia [ Cancer Cell, 2022, S1535-6108(22)00312-9] | PubMed: 35868306 |
| SFRP4+ stromal cell subpopulation with IGF1 signaling in human endometrial regeneration [ Cell Discov, 2022, 8(1):95] | PubMed: 36163341 |
| Comprehensive drug response profiling and pan-omic analysis identified therapeutic candidates and prognostic biomarkers for Asian cholangiocarcinoma [ iScience, 2022, 25(10):105182] | PubMed: 36248745 |
| Strong Synergic Growth Inhibition and Death Induction of Cancer Cells by Astragalus membranaceus and Vaccaria hispanica Extract [ Cancers (Basel), 2022, 14(23)5833] | PubMed: 36497315 |
| Differential cytotoxic activity of pharmacological inhibitors of IGF1R-related pathways in JAK2V617F driven cells [ Toxicol In Vitro, 2022, 83:105384] | PubMed: 35568132 |
| Targeting Aurora B kinase prevents and overcomes resistance to EGFR inhibitors in lung cancer by enhancing BIM- and PUMA-mediated apoptosis [ Cancer Cell, 2021, S1535-6108(21)00383-4] | PubMed: 34388376 |
| Three subtypes of lung cancer fibroblasts define distinct therapeutic paradigms [ Cancer Cell, 2021, S1535-6108(21)00492-X] | PubMed: 34624218 |
| Aerobic exercise and resistance exercise alleviate skeletal muscle atrophy through IGF-1/IGF-1R-PI3K/Akt pathway in mice with myocardial infarction [ Am J Physiol Cell Physiol, 2021, 10.1152/ajpcell.00344.2021] | PubMed: 34852207 |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
