Technische gegevens
| Formule | C27H20ClFN4O4 |
||||||
| Molecuulgewicht | 518.92 | CAS-nr. | 1028486-01-2 | ||||
| Oplosbaarheid (25°C)* | In vitro | DMSO | 33 mg/mL (63.59 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In Vivo (Voeg oplosmiddelen afzonderlijk en in volgorde toe aan het product.) |
|
||||||
|
* <1 mg/ml betekent licht oplosbaar of onoplosbaar. * Houd er rekening mee dat Selleck de oplosbaarheid van alle verbindingen intern test en de werkelijke oplosbaarheid enigszins kan afwijken van gepubliceerde waarden. Dit is normaal en is te wijten aan lichte batch-tot-batch variaties. * Verzending op kamertemperatuur (Stabiliteitstests tonen aan dat dit product zonder koelmaatregelen kan worden verzonden.) |
|||||||
Voorbereiden van stamoplossingen
Biologische activiteit
| Beschrijving | Alisertib (MLN8237) is een selectieve Aurora A-remmer met een IC50 van 1,2 nM in een celvrije test, en het heeft een >200-voudig hogere selectiviteit voor Aurora A dan Aurora B. Deze verbinding induceert celcyclusarrest, apoptose en autophagy. Fase 3. | ||
|---|---|---|---|
| Doelen |
|
||
| In vitro | Alisertib (MLN8237) vertoont een >200-voudig hogere selectiviteit voor Aurora A dan de structureel verwante Aurora B met een IC50 van 396,5 nM, en heeft geen significante activiteit tegen 205 andere kinasen. Behandeling met deze verbinding (0,5 µM) remt de fosforylering van Aurora A in MM1.S- en OPM1-cellen, zonder de Aurora B-gemedieerde histon H3-fosforylering te beïnvloeden. Het remt significant de celproliferatie in multipel myeloom (MM) cellijnen met IC50-waarden van 0,003-1,71 µM, en vertoont een potentere anti-proliferatieactiviteit tegen primaire MM-cellen en MM-cellijnen in aanwezigheid van BM-stromacellen, evenals IL-6 en IGF-1, dan tegen MM-cellen alleen. Bij 0,5 µM induceert het een 2- tot 6-voudige toename in de G2/M-fase in primaire MM-cellen en cellijnen, evenals significante apoptosis en veroudering, waarbij de opregulatie van p53, p21 en p27, evenals PARP, caspase 3 en caspase 9-splitsing betrokken zijn. Bovendien vertoont het een sterk synergetisch anti-MM-effect met Hexadecadrol, evenals een additief effect met doxorubicine en LDP-341. Deze verbinding (0,5 µM) behandeling veroorzaakt de remming van de kolonieformatie van FLO-1, OE19 en OE33 slokdarmadenocarcinoom-cellijnen, en induceert een significante toename van het percentage polyploïde cellen, en vervolgens een toename van het percentage cellen in de sub-G1-fase, wat verder kan worden verbeterd in combinatie met NSC 119875 (2,5 µM), waarbij de hogere inductie van TAp73β, PUMA, NOXA, gekliefd caspase-3 en gekliefd PARP betrokken zijn in vergelijking met een behandeling met een enkel agens. |
||
| In Vivo | Alisertib (MLN8237) vermindert significant de tumorgrootte met een tumorremming (TGI) van 42% en 80% bij respectievelijk 15 mg/kg en 30 mg/kg, en verlengt de overleving van muizen in vergelijking met de controle. |
||
| Functies | Eerste oraal beschikbare remmer van Aurora A. |
Protocol (uit referentie)
| Kinase-assay: |
|
|---|---|
| Celassay: |
|
| Dierstudie: |
|
Referenties
|
Klantproductvalidatie
-S113303W0120130926.gif)
-
Gegevens van [ Oncogene , 2014 , 33, 3550-60 ]
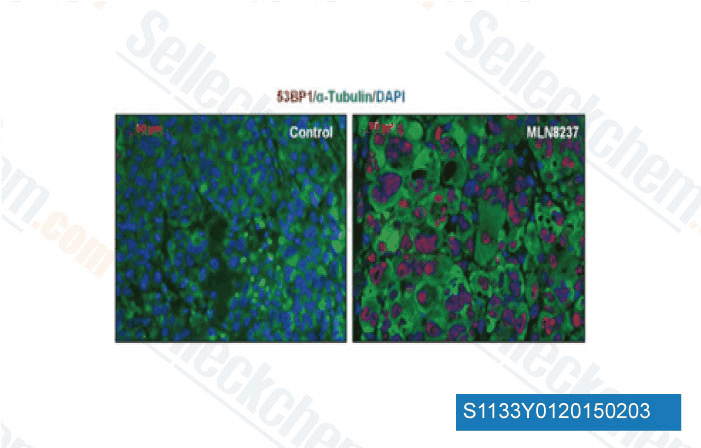
-
Gegevens van [ EMBO Mol Med , 2013 , 5(1), 149-66 ]
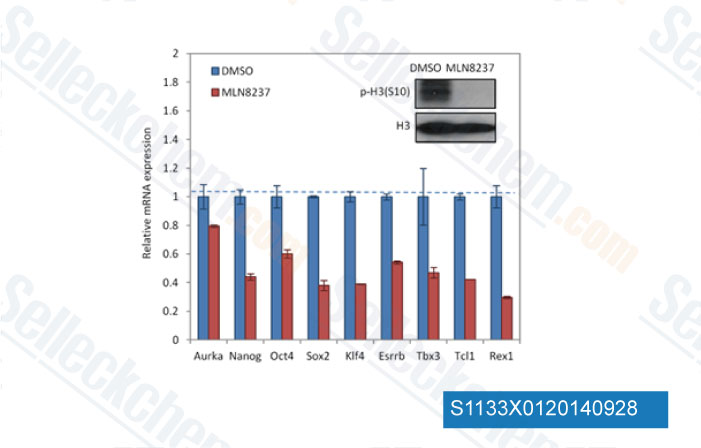
-
Gegevens van [ Cell Stem Cell , 2012 , 11, 179-94 ]
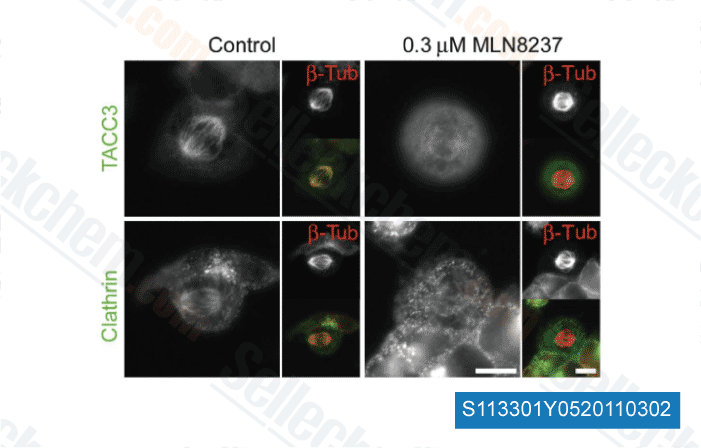
-
Gegevens van [ EMBO J , 2012 , 30, 906-19 ]
Sellecks Alisertib (MLN8237) Is geciteerd door 380 Publicaties
| Centromere protection requires strict mitotic inactivation of the Bloom syndrome helicase complex [ Nat Commun, 2025, 16(1):7832] | PubMed: 40846865 |
| Aurora A regulates the material property of spindle poles to orchestrate nuclear organization at mitotic exit [ EMBO J, 2025, 10.1038/s44318-025-00564-4] | PubMed: 40940421 |
| Targeted inhibition of Aurora kinase A promotes immune checkpoint inhibition efficacy in human papillomavirus-driven cancers [ J Immunother Cancer, 2025, 13(1)e009316] | PubMed: 39773561 |
| An Aurora kinase A-BOD1L1-PP2A B56 axis promotes chromosome segregation fidelity [ Cell Rep, 2025, 44(2):115317] | PubMed: 39970043 |
| The AURKA inhibitor alters the immune microenvironment and enhances targeting B7-H3 immunotherapy in glioblastoma [ JCI Insight, 2025, e173700] | PubMed: 39928563 |
| CDK1-mediated phosphorylation of LDHA fuels mitosis through LDHB-dependent lactate oxidation [ EMBO Rep, 2025, 10.1038/s44319-025-00573-8] | PubMed: 40940446 |
| Cellular senescence as a prognostic marker for predicting breast cancer progression in 2D and 3D organoid models [ Biomed Pharmacother, 2025, 189:118324] | PubMed: 40616881 |
| Actionable heterogeneity of hepatocellular carcinoma therapy-induced senescence [ Cancer Immunol Immunother, 2025, 74(7):207] | PubMed: 40374812 |
| Aurora B maintains spherical shape of mitotic cells via simultaneously stabilizing myosin II and vimentin [ J Mol Cell Biol, 2025, mjaf023] | PubMed: 40795355 |
| O 6-methylguanine DNA methyltransferase (MGMT) expression in U1242 glioblastoma cells enhances in vitro clonogenicity, tumor implantation in vivo, and sensitivity to alisertib-carboplatin combination treatment [ Front Cell Neurosci, 2025, 19:1552015] | PubMed: 40336841 |
RETOURBELEID
Selleck Chemicals onvoorwaardelijke retourbeleid zorgt voor een soepele online winkelervaring voor onze klanten. Als u op enigerlei wijze ontevreden bent met uw aankoop, kunt u elk artikel(en) binnen 7 dagen na ontvangst retourneren. In geval van problemen met de productkwaliteit, zowel protocolgerelateerde als productgerelateerde problemen, kunt u elk artikel(en) binnen 365 dagen na de oorspronkelijke aankoopdatum retourneren. Volg de onderstaande instructies bij het retourneren van producten.
VERZENDING EN OPSLAG
Selleck producten worden bij kamertemperatuur vervoerd. Als u het product op kamertemperatuur ontvangt, wees dan gerust, de Selleck kwaliteitsinspectieafdeling heeft experimenten uitgevoerd om te controleren of de normale temperatuurplaatsing van één maand de biologische activiteit van poederproducten niet beïnvloedt. Na ontvangst dient u het product op te slaan volgens de vereisten beschreven in het gegevensblad. De meeste Selleck producten zijn stabiel onder de aanbevolen omstandigheden.
NIET VOOR HUMANE, VETERINAIRE DIAGNOSTISCHE OF THERAPEUTISCHE DOELEINDEN.
